2025年6月3日,空军军医大学基础医学部生理与病理生理教研室联合西安交通大学团队在Cell Metabolism(IF=27.7)在线发表题为“O-GlcNAcylation-mediated endothelial metabolic memory contributes to cardiac damage via small extracellular vesicles”的研究论文,本研究揭示了一种通过O-GlcNA酰化实现内皮代谢记忆的新机制,并确定了糖尿病EC衍生的小细胞外囊泡(sEVs)的记忆特征会导致心脏损伤。

· 维真助力 - AAV & Ad ·
In vivo
①基因信息 miR-15-16
病毒产品 AAV9-RGDLRVS-ICAM2-miR-15-16 sponges、AAV9-RGDLRVS-ICAM2-NC
实验动物 6-8周龄雄性c57小鼠
注射方式 尾静脉注射
注射剂量 100μL,1×1012vg/mouse
②基因信息 CaMK2a:钙/钙调蛋白依赖性蛋白激酶 II α
病毒产品 Ad-ICAM2-CaMK2a-Flag-WT、Ad-ICAM2-CaMK2a-Flag-T306A
注射方式 颈动脉注射
注射剂量 10μL,2.5×1010 pfu/ml
In vitro
基因信息 Stat1:一种信号转导及转录激活因子
病毒产品 Ad-Stat1
感染细胞 小鼠主动脉内皮细胞 (MAECs)
MOI 40, 1.2×1010 PFU/ml
感染时间 48h
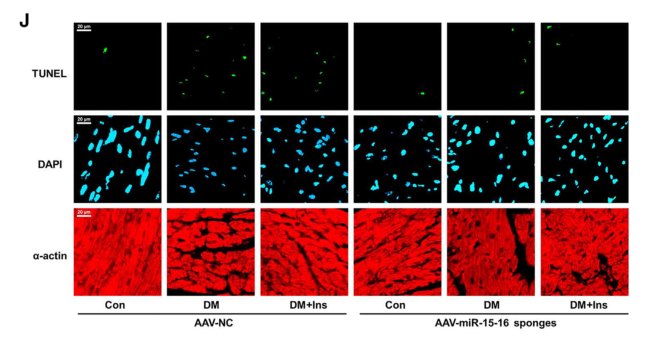
AAV感染后TUNEL和DAPI染色的代表性图像
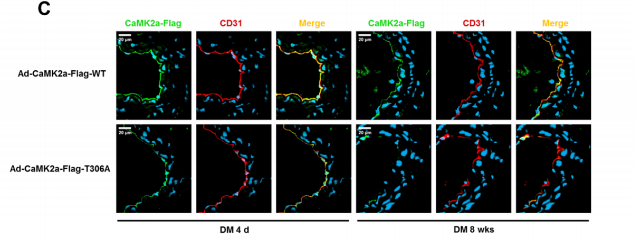
小鼠颈动脉中CD31(内皮细胞标志物)与CaMK2a-Flag共免疫荧光染色的代表性图像
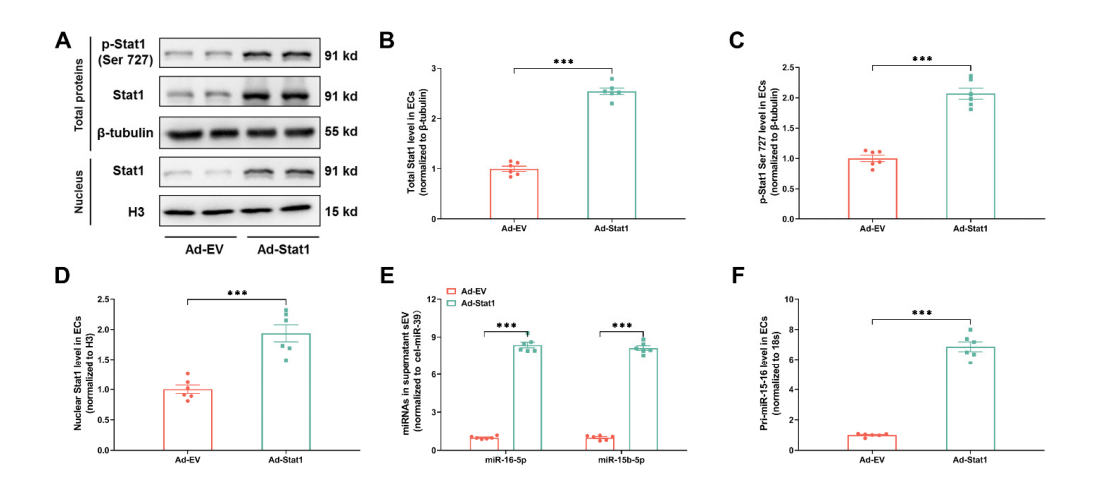
Ad-Stat1表达后 Stat1及miR-16-5p 等相关基因的水平检测
01 研究背景
糖尿病(DM)的患病率显著增加,已成为一个主要的全球公共卫生问题。众所周知,糖尿病显著增加了心力衰竭的风险,与缺血性心脏病或其他并发症的存在无关;另一方面,临床证据也表明,在心力衰竭患者中,糖尿病是不良预后的关键决定因素。尽管治疗后血糖恢复正常,但高血糖产生的适应不良特征仍然存在。据推测,血管系统中早期的高血糖可能会被内皮细胞(ECs)记住,从而导致随后的心血管并发症。这种现象被称为“高血糖记忆”或“代谢记忆”,主要用于描述高血糖对血管并发症的长期负面影响。然而,代谢记忆在糖尿病心肌病或心力衰竭发展中的作用在很大程度上仍不清楚。
02 研究结果分享
1、代谢记忆产生的sEV miR-15-16上调FoxO1信号传导
作者通过体内外实验研究发现在8周的高血糖(HG)应激后,糖尿病来源的循环小细胞外囊泡(sEVs)对心肌细胞产生持续性不利影响,并在健康动物中诱导心脏功能障碍,尽管后续血糖恢复正常。这表明HG诱导的循环sEVs表现出“记忆”特征,可能促使糖尿病患者残留部分心力衰竭风险。考虑到在糖尿病8周时sEVs产生的不良影响,对从8周糖尿病和非糖尿病对照组大鼠血浆中收集的sEVs进行高通量RNA测序,鉴定发现miR-15b-5p和miR-16-5p是代谢记忆产生的循环sEVs中的作用分子。miR-15b-5p和miR-16-5p被转录为miR-15-16,位于同一染色体区域,并且高度保守,考虑到两者的协同作用,后续使用其模拟物或抑制剂探究了miR-15-16诱导心肌细胞凋亡的分子机制。结果表明,sEVs miR-15-16靶向FoxO1信号通路的一系列上游调节因子,并通过上调心肌细胞中的FoxO1发挥促凋亡作用,进而导致心脏功能障碍。
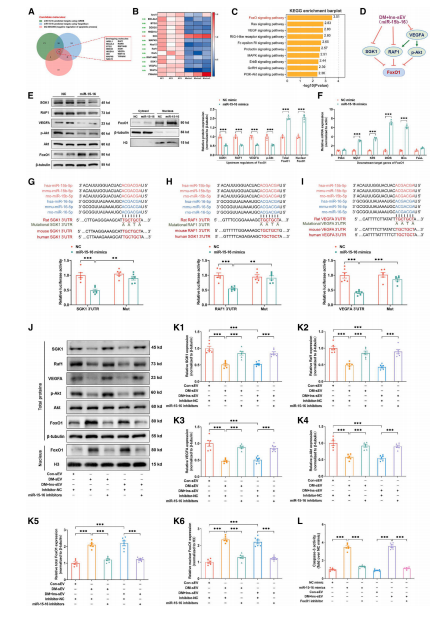
图1. 代谢记忆产生的sEV miR-15-16上调FoxO1信号传导
2、抑制内皮细胞miR-15-16可减轻代谢记忆诱导的心脏损伤和功能障碍
作者进一步研究发现代谢记忆诱导动脉内皮细胞分泌sEV miR-15-16,为了探索内皮miR-15-16在体内代谢记忆诱导的心脏功能障碍中的作用,作者利用AAV9介导miR-15-16海绵递送给小鼠,实现了EC特异性的miR-15-16敲低。与NC海绵组相比,EC特异性miR-15-16海绵组血浆sEV miR-15-16的表达显著降低,表明动脉EC是代谢记忆诱导的血浆sEV miR-15-16的主要来源。此外,在DM或DM+Ins(代谢记忆动物模型)组中,EC特异性miR-15-16敲低降低了心肌miR-15-16的表达,改善了心功能,并抑制了心肌细胞凋亡和FoxO1的表达。这些数据表明,内皮细胞分泌的sEV miR-15-16参与了代谢记忆诱导的心脏损伤和功能障碍。
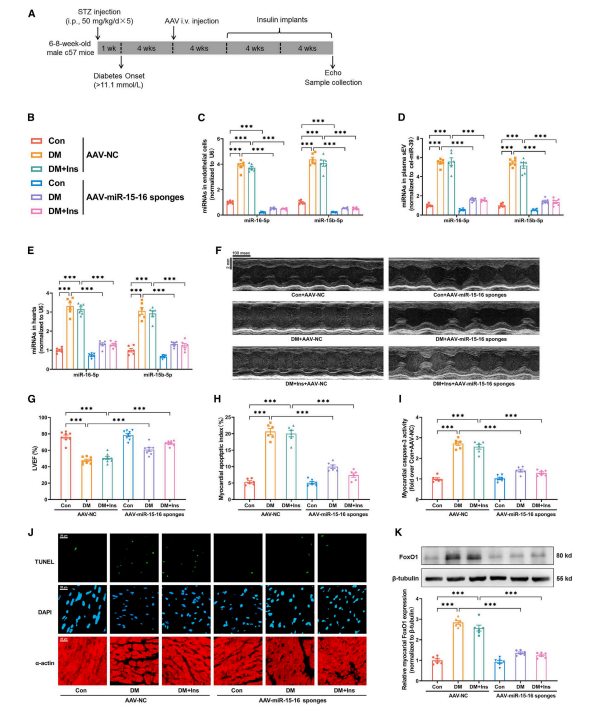
图2. 抑制内皮细胞miR-15-16可减轻代谢记忆诱导的心脏损伤和功能障碍
3、敲低内皮细胞CaMK2a-Stat1信号转导抑制代谢记忆诱导的sEV miR-15-16分泌和心脏功能障碍
作者进一步探究了代谢记忆促进ECs分泌sEV miR-15-16的机制,发现HG对miR-15-16的作用可能通过诱导蛋白质O-GlcNAc糖基化介导。糖尿病动脉ECs中O-GlcNAc糖基化、CaMK2a活性、CaMK2a-Stat1结合以及Stat1在Ser727位点的磷酸化均显著升高,即使后期通过胰岛素植入实现血糖正常化,这些指标仍显著升高。利用腺病毒在ECs中过表达Stat1,实验发现Stat1可以与pri-miR-15-16启动子结合,以增强EC中sEV miR-15-16的分泌。随后,作者通过抑制CaMK2a/Stat1探究了内皮细胞CaMK2a-Stat1信号传导在代谢记忆诱导的sEV miR-15-16分泌上调中的作用,结果表明内皮细胞CaMK2a-Stat1信号传导介导代谢记忆诱导的血浆sEV miR-15-16上调,并诱导心脏功能障碍。
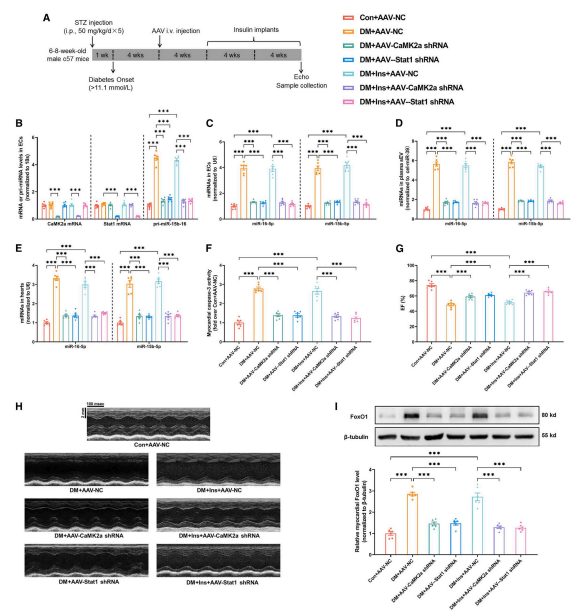
图3. 敲低内皮细胞CaMK2a-Stat1信号转导抑制代谢记忆诱导的sEV miR-15-16分泌和心脏功能障碍
4、早期胰岛素治疗或O-GlcNAc修饰抑制可阻断高血糖诱导的记忆信号并预防糖尿病性心肌损伤
前期工作鉴定Thr306为CaMK2a的潜在GlcNAc修饰位点,对该位点进行突变试验。利用腺病毒在EC中表达外源野生型或T306A突变体CaMK2a-Flag,证明了Thr306位点的O-GlcNAc修饰是CaMK2a促进Stat1磷酸化及后续sEV miR-15-16分泌所必需的。进一步实验表明O-GlcNAc修饰的CaMK2a在体内具有很高的稳定性。CaMK2a调节pri-miR-15/16的表达,并通过磷酸化Stat1影响心肌细胞。尽管糖尿病发病8周后开始的晚期胰岛素治疗无法减轻代谢记忆和防止心脏功能障碍的发展,但是探究糖尿病发病初期早期胰岛素治疗或O-GlcNAc修饰抑制剂(OSMI,1 mg/kg/天)是否能有效阻断内皮记忆信号和心脏损伤具有重要意义。结果表明,蛋白质O-GlcNA化直接介导糖尿病诱导的有害变化,而早期血糖控制能够抑制代谢记忆信号传导并预防糖尿病诱导的损伤。作者进一步验证了实验结果的转化适用性,从糖尿病个体和健康志愿者中提取了血浆sEVs,并通过多元分析发现血浆sEV miR-16-5p和miR-15b-5p在预防糖尿病患者心脏功能障碍方面具有转化潜力。
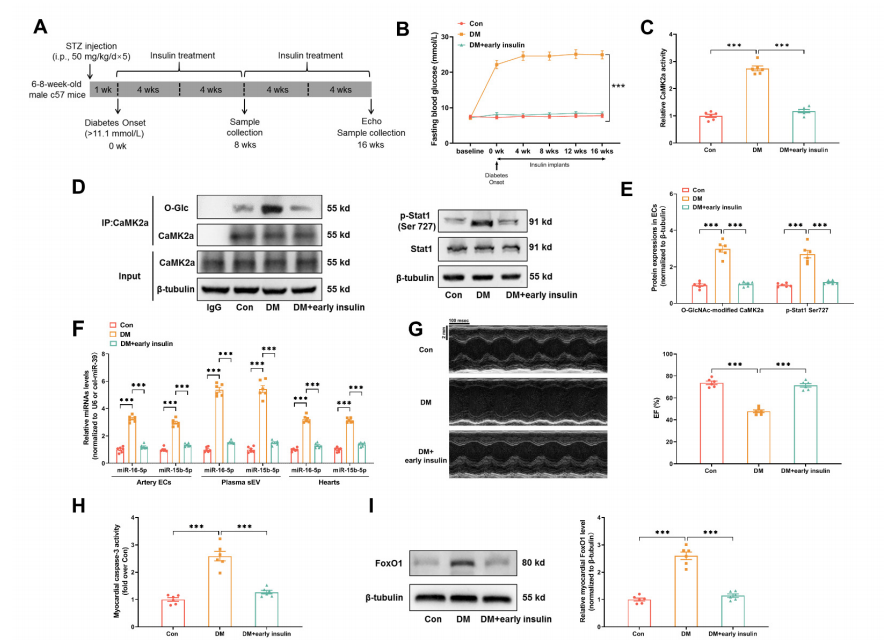
图4. 早期胰岛素治疗或O-GlcNAc修饰抑制可阻断高血糖诱导的记忆信号并预防糖尿病性心肌损伤
03
结论
本研究表明糖尿病患者治疗后尽管血糖恢复正常,但代谢记忆衍生的循环sEV miR-15-16对心肌细胞产生了深远而持续的有害影响。高糖诱导的CaMK2a/O-GlcNA化的正反馈回路即使在GLU正常化后也能维持内皮CaMK2a-Stat1通路的激活,该通路介导代谢记忆并促进sEV miR-15-16的持续释放。靶向内皮O-GlcNAc-CaMK2a-Stat1通路或sEV miR-15-16为消除糖尿病代谢记忆及其相关并发症提供了一种有前景的治疗方法。
